QUÍMICA BÁSICA: TABELA PERIÓDICA
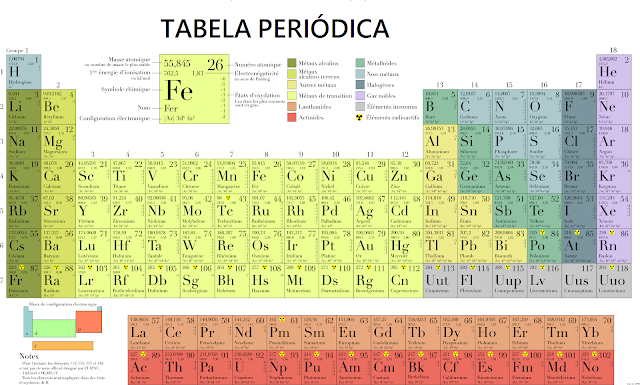
A Tabela Periódica é a organização de todos os elementos químicos tendo como principal princípio organizador o número atômico (Z). O número atômico (Z) corresponde ao número de prótons e também indica o número de elétrons do átomo eletricamente neutro. O átomo eletricamente neutro é o átomo em seu estado natural no qual o número de elétrons e prótons é o mesmo.
A Tabela Periódica é dividida em períodos. Os períodos são as colunas horizontais, a Tabela Periódica apresenta sete colunas horizontais, portanto, sete períodos, de 1 a 7 em conformidade com as sete camadas eletrônicas (K, L, M, N, O, P, Q). A Tabela Periódica é também dividida por famílias. As famílias são as colunas verticais, elas são organizadas com base no número de elétrons na camada de valência. A camada de valência é a camada mais externa de um elemento químico, é nela que acontecem as ligações.
Nos elementos representativos, o número da família é igual ao número de elétrons na camada de valência. O elétron de valência encontra-se no subnível s ou p nos elementos representativos. Nos elementos intermediários de transição, o elétron de valência se encontra no subnível d (transição simples) ou f (transição interna). A imagem abaixo mostra a classificação dos elementos em elementos representativos, elementos de transição simples e os elementos de transição interna e como eles aparecem agrupados na tabela:
As famílias são as seguintes:
1A: Metais alcalinos: seus elementos possuem 1 elétron na camada de valência (o Hidrogênio é o único elemento da família 1A que não é um metal alcalino).
2A: Metais Alcalinos terrosos: seus elementos possuem 2 elétrons na camada de valência.
3A: Família do Boro: seus elementos possuem 3 elétrons na camada de valência.
4A: Família do Carbono: seus elementos possuem 4 elétrons na camada de valência.
5A: Família do Nitrogênio: seus elementos possuem 5 elétrons na camada de valência.
6A: Família dos Calcogênios: seus elementos possuem 6 elétrons na camada de valência.
7A: Família dos Halogênios: seus elementos possuem 7 elétrons na camada de valência.
8A ou 0: Família dos Gases nobres: seus elementos possuem 8 elétrons na camada de valência.
Os gases nobres são inertes, não se misturam com outras substâncias. Em geral, os átomos devem possui oito elétrons em sua camada de valência de modo a adquirir estabilidade química.
A Tabela Periódica permite observar determinadas propriedades dos elementos químicos a depender do local em que ocupam no todo da tabela. Os elementos químicos podem ser classificados em três grupos:
(1) Metais: este grupo possui 87 elementos, eles são sólidos em condições ambientes normais (com exceção do mercúrio - Hg), possuem alta condutividade elétrica (principalmente a prata – Ag – e o cobre – Cu); são bons condutores de calor, são dúcteis e maleáveis, possuem brilho e possuem tendência a formar cátions, isto é, a perder elétrons;
(2) Não - metais: este grupo possui 18 elementos, a maioria gasosos, são maus condutores de calor e eletricidade, possuem tendência a formar ânions, isto é, a ganhar elétrons (com exceção do hidrogênio - H e dos gases nobres);
(3) Semimetais: este grupo é formado por 7 elementos, eles são sólidos, possuem propriedades intermediárias em relação aos metais e não-metais e entre eles, o Si (silício) e o Ge (germânio) são dispositivos semicondutores.
Podemos considerar, ainda, na Tabela Periódica, os elementos artificiais. Os elementos artificiais são aqueles que não se encontram naturalmente na superfície terrestre, tendo sido criados em laboratórios. Eles podem ser classificados em dois grupos: (i) Cisurânicos: possuem número atômico inferior ao Urânio (Z<92), são eles - Tecnécio (Tc); Promécio (Pm); Ástato (At) e Frâncio (Fr); (ii) Transurânicos: possuem número atômico maior do que o do Urânio (Z>92).
Podemos ainda considerar as propriedades periódicas no sentido das características dos elementos químicos que variam de forma padrão de acordo com sua posição na tabela. São elas:
(1) Raio Atômico: é a distância do núcleo ao elétron mais externo de um elemento. Será maior quanto mais à esquerda e quanto mais abaixo na tabela. ⬇⬅
(2) Energia de Ionização: energia mínima necessária para remover um elétron de um elemento. Será maior quanto mais acima e mais à direita na tabela. ⬆➡
(3) Eletroafinidade: energia liberada quando o átomo recebe um elétron. Será maior quanto mais acima e à direita (com exceção dos gases nobres. ⬆➡
(4) Eletropositividade: também chamado de caráter metálico, é a facilidade que um elemento químico tem de perder um elétron. É maior à esquerda e para baixo. ⬇⬅
(5) Densidade: relação entre massa e volume. O ósmio (Os) é o elemento com maior densidade e os elementos terão maior densidade quanto mais próximos estiverem dele.
(6) Ponto de Fusão e Ponto de Ebulição: O Ponto de Fusão (PF) corresponde à temperatura em que determinado material passa do estado sólido para o líquido e o Ponto de Ebulição (PE) é a temperatura em que um material passa do estado líquido para o gasoso. O Tungstênio (W) é o elemento com maior PF (3422 °C) e PE (5555°C). PF e PE dos elementos serão maiores à medida em que se aproximarem de W, com exceção dos elementos das famílias 1A e 2A, que terão maior PF e PE quanto mais em cima estiverem.
______________________________________________________
Referências:











Comentários