QUÍMICA BÁSICA: NÚMEROS QUÂNTICOS
O objetivo deste texto é apresentar os números quânticos, que são unidades matemáticas utilizadas para definir a energia de um elétron, funcionando como uma espécie de endereço que possibilita localizá-lo. Os números quânticos são de quatro tipos: (i) número quântico principal (N): indica o nível em que está o elétron; (ii) número quântico secundário ou azimutal (L): indica o subnível em que está o elétron; (iii) número quântico magnético (m): indica o orbital em que está o elétron; (iv) número quântico de rotação (spin): indica o sentido de rotação de um elétron. Consideraremos cada um deles, no entanto, será preciso apresentar antes uma noção geral de estrutura atômica.
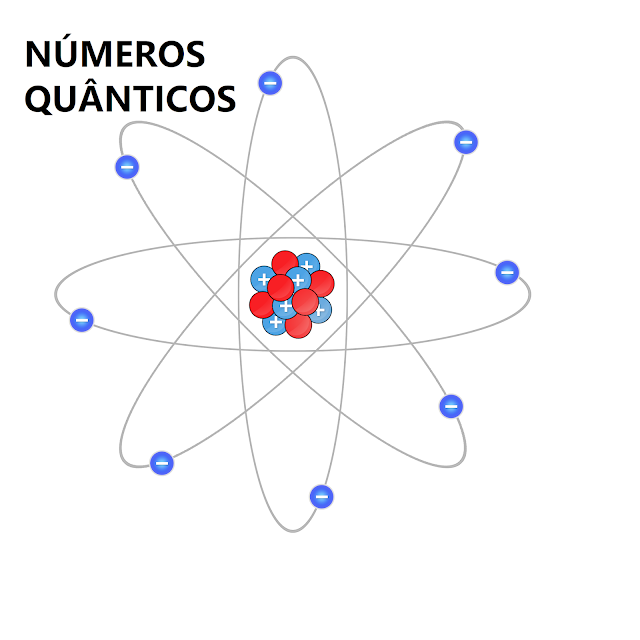
Podemos representar um átomo a partir de um modelo planetário, no qual temos o núcleo no centro e orbitando o núcleo encontramos diferentes níveis de energia. No núcleo encontramos presentes os prótons que possuem carga positiva (+) e os nêutrons que possuem carga nula (0), enquanto nos níveis (que constituem o que podemos chamar de “eletrosfera”) encontram-se os elétrons, que possuem carga negativa (-). A estrutura aqui descrita pode ser representada assim:
A massa (A) de um átomo é determinada pelo número de prótons (P) mais o número de nêutrons (n), de modo que A= P + n. Por sua vez, o número atômico (Z) nada mais é do que o número de prótons (P), assim: Z = P. Por conseguinte, temos que A = Z + n. Quando dois ou mais átomos possuem o mesmo número de prótons no núcleo, dizemos que eles fazem parte do mesmo elemento químico. Por elemento químico entende-se o conjunto de átomos que possuem as mesmas propriedades. Chamamos de isótopos, aos átomos com o mesmo número de prótons (Z). Por sua vez, denominamos como isóbaros, elementos que possuem o mesmo número de massa (A). Por fim, consideramos como isótonos, elementos com o mesmo número de nêutrons (n).
O átomo em seu estado natural é eletricamente neutro, isso significa que ele possui o mesmo número de prótons e elétrons. Considerando o número de elétrons (E), num estado natural de um átomo temos E = Z. No entanto, um átomo pode adquirir carga ganhando ou perdendo elétrons. Chamamos de íon ao átomo com carga. O átomo que perde elétrons, ficando assim com carga positiva, é designado como cátion. Já o átomo que ganha elétrons, ficando assim com carga negativa, chamamos de ânion. Designamos como espécies isoeletrônicas àquelas que apresentam o mesmo número de elétrons.
Tendo considerado de forma geral a estrutura atômica, podemos tratar dos números quânticos. As camadas eletrônicas que constituem a eletrosfera podem ser chamadas de “níveis de energia”. Chamamos de camada de valência à camada mais externa de um elemento químico. Os níveis de energia são representados pelas letras K, L, M, N, O, P, Q. Cada nível pode conter um determinado número máximo de elétrons: K (2); L (8); M (18), N(32), O (32), P (18), Q (2). Cada nível pode ser representado por um número, esse número é o que chamamos de número quântico principal (N) : K (1), L (2), M (3), N(4), O (5), P (6), Q (7). Assim, temos a seguinte tabela:
Os níveis, no entanto, podem ser subdivididos, de modo que podemos falar em subníveis de energia. Os subníveis são representados pelas seguintes letras: s, p, d, f. O número máximo de cada subnível é: s (2); p (6); d (10); f (14). Cada subnível pode ser representado por um número, a esse número designamos como número quântico secundário ou número quântico azimutal (L): s (0), p (1), d (2) f (3). Assim, temos a seguinte tabela:
Dentro de um subnível existem regiões de espaço nas quais pode haver maior probabilidade de se encontrar um determinado elétron. Essas regiões são os orbitais. Em cada orbital cabem dois elétrons, por isso, o número do orbital é representado pela metade do número máximo de elétrons de casa subnível. O número da região de espaço orbital no qual se encontra determinado elétron chama-se número quântico magnético (m). A representação de cada região de espaço orbital pode ser feita graficamente por quadrados, em cada "quadrado" cabem dois elétrons. Assim temos a seguinte tabela:
Por fim, o número quântico de rotação (spin) representa o sentido de rotação de um elétron. Por convenção consideramos que esse sentido pode ser +½ ou –½. Cada elétron de um orbital gira em sentido distinto do que se encontra ao seu lado. A direção distinta dos elétrons pode ser representada por uma seta para cima ou para baixo. Em cada região orbital consideramos um elétron na direção +½ e outro na direção - ½ . A contagem para considerar a localização do elétron é feita contabilizando todas as setas numa direção em cada orbital para depois considerar as setas em sentido oposto; essa contabilização pode ser chamada de ordem de entrada. A tabela a seguir ilustra a presença de um elétron no subnível d, com ordem de entrada 7, de modo que temos L=2 e m= - 1. Tomando a seta para cima como +½ e a seta para baixo como –½, teremos spin= -½.
Para facilitar a representação da ordem de energia de cada nível, podemos usar a Distribuição de Linus Pauling, nela, o número maior à esquerda se refere à camada ou nível, a letra representa o subnível e o número superior à direita diz respeito à quantidade de elétrons que cabem no subnível em questão:
Referência:
KULTIVI, Química | ENEM - Números Quânticos | CURSO GRATUITO COMPLETO | CURSO GRATUITO COMPLETO. Dispobível em: https://youtu.be/wu7aN-O1z_4
















Comentários