QUÍMICA BÁSICA: GEOMETRIA MOLECULAR E FORÇAS INTERMOLECULARES
A geometria molecular diz respeito aos formatos das moléculas, que são diversos. O formato de uma molécula depende da orientação dos átomos ao redor do átomo central e do ângulo entre as ligações químicas. Nesse sentido, para definir a geometria molecular de uma molécula, é preciso primeiro determinar o átomo central e, em seguida, realizar todas as ligações iônicas e covalentes possíveis. No caso de sobrar átomos que não completem o octeto, é preciso considerar as dativas. No entanto, vale ressaltar que em oxiácidos, os hidrogênios sempre se encontram ligados em oxigênios.
Em geometria molecular, é preciso levar em conta a Teoria da Repulsão Eletrônica. Segundo essa teoria, os pares eletrônicos que envolvem o átomo central repelem-se mutuamente e, portanto, apresentam-se da maneira mais afastada possível. Outro ponto em geometria molecular, é o conceito de nuvens eletrônicas. Nuvens eletrônicas são “grupos” de elétrons ao redor do átomo central. A ligação simples, a ligação tripla e os pares de elétrons livres podem ser considerados nuvens eletrônicas.
Para prever uma geometria molecular, primeiro se monta a forma eletrônica, deixando as nuvens eletrônicas do átomo central o mais afastadas possível. Os pares de elétrons servem de orientação para a geometria molecular, enquanto o núcleo dos átomos é aquilo que determina essa geometria. Dado isso, temos as seguintes possibilidades de geometrias moleculares:
(1) As moléculas diatômicas e as moléculas com duas nuvens eletrônicas formam sempre figuras lineares, de modo que o ângulo de suas ligações será sempre de 180°:
(2) Uma molécula com três nuvens eletrônicas e três ligantes no átomo central forma uma figura trigonal plana, isto é, um triângulo equilátero com ângulo de ligação de 120°:
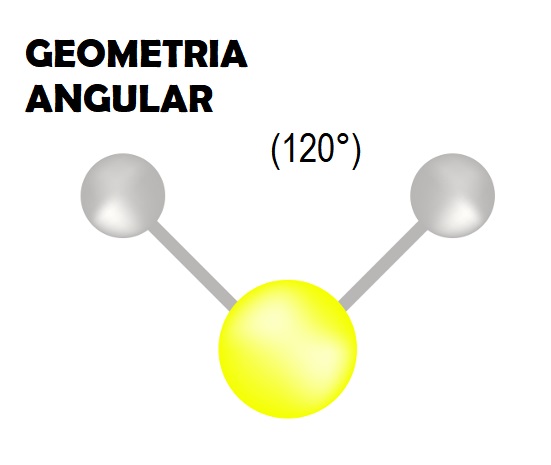
(3) Uma molécula com três nuvens eletrônicas e dois ligantes no átomo central forma uma figura angular com ângulo de 120°:
(4) Uma molécula com quatro nuvens eletrônicas e quatro ligantes no átomo central forma uma figura tetraédrica espacial com ângulo de 109,5°:
(5) Uma molécula com quatro nuvens eletrônicas e três ligações no átomo central forma uma figura piramidal com 109,5°:
(6) Uma molécula com quatro nuvens eletrônicas e dois ligantes forma uma figura angular com 109,5°:
Quanto às forças intermoleculares, definimos que uma força intermolecular é aquela que mantém as moléculas unidas. Ela é responsável pelo estado físico da matéria. Há três estados físicos principais da matéria:
(1) Estado sólido: é aquele no qual as moléculas apresentam movimento vibratório em posição fixa.
(2) Estado líquido: é aquele no qual as moléculas se movimentam umas sobre as outras.
(3) Estado gasoso: é aquele no qual as moléculas possuem grande liberdade de movimento.
As forças intermoleculares dependem da distribuição de elétrons ao redor dos átomos, o que se denomina como polaridade. Quando a distribuição é simétrica, isto é, quando há a mesma quantidade de elétrons em todas as partes do átomo, temos uma molécula apolar, ou seja, uma molécula cuja carga elétrica é igual em todas as suas partes. Por outro lado, quando a distribuição de elétrons ao redor dos átomos é desigual, temos uma molécula apolar, o que significa que essa molécula possui um polo levemente positivo (com menos elétrons) e um polo levemente negativo (com mais elétrons). É importante considerar que as forças intermoleculares guardam dependência com a geometria molecular.
Podemos considerar as seguintes forças intermoleculares:
(1) Força dipolo-dipolo: é aquela que liga as moléculas polares entre si, de modo a formar um dipolo elétrico permanente. Isso significa que haverá um polo negativo e um polo positivo. Assim, a extremidade positiva atrai a extremidade negativa e vice-versa.
(2) Ligação de hidrogênio: é aquela que ocorre quando o hidrogênio (H) se encontra ligado ao flúor (F), oxigênio (O) e nitrogênio (N). Nesse tipo de ligação, o hidrogênio (H) fica com deficiência de elétrons e interage com o par eletrônico da molécula vizinha. As ligações de hidrogênio são mais fortes que as dipolo-dipolo e causam Pontos de Fusão (PF) e Pontos de Ebulição (PE) elevados.
(3) Dipolo instantâneo – dipolo induzido: também denominada como Forças de London ou Forças de Van der Waals, é aquela que apresenta forças fracas que atuam em todas as moléculas e é a única que age em moléculas apolares. Essas forças se apresentam numa molécula em que há uma nuvem eletrônica na qual existe uma nuvem eletrônica que, em geral, se encontra distribuída uniformemente. Essa nuvem eletrônica se movimenta criando um dipolo instantâneo. O dipolo instantâneo, por sua vez, atrai elétrons da molécula vizinha, gerando um dipolo induzido. Essa ligação é mais fraca que a dipolo-dipolo.
As forças intramoleculares são aquelas que mantêm a molécula unida, podendo ser de três tipos, indo da mais fraca para a mais forte:
Ligação covalente < ligação covalente polar < ligação iônica.
Já as forças intermoleculares são aquelas que unem as moléculas, indo da mais fraca para a mais forte, são elas:
Dipolo instantâneo-dipolo induzido < dipolo-dipolo < ligação de hidrogênio
Pode-se considerar ainda as ligações metálicas. Os metais possuem baixos valores de potencial de ionização, tendo a tendência de perder elétrons. Nas ligações metálicas, os metais perdem elétrons juntos formando cátions, de modo que se forma um retículo mergulhado em uma nuvem eletrônica. Na ligação metálica ocorre uma atração mútua entre os cátions e a nuvem eletrônica. Nessas ligações, os átomos não obedecem ao octeto, sendo que os metais em geral são poliatômicos. Os metais possuem as seguintes propriedades: brilho; alta condutividade térmica e elétrica; maleabilidade; ductibilidade; alto Ponto de Fusão (PF) e Ponto de Ebulição (PE); tenacidade e; dureza.
Os metais também podem ser encontrados na forma de ligas metálicas, que são misturas de dois ou mais metais. São exemplos de ligas metálicas:
(1) Latão: Cobre (Cu) e zinco (Zn).
(2) Bronze: Cobre (Cu), estanho (Sn) e zinco (Zn).
(3) Amálgama: Mercúrio (Hg) e outros metais.
(4) Aço: Ferro (Fe) com 0,5% a 1,7% de carbono (C).
(5) Ouro: Ouro (Au) e cobre (Cu) ou prata (Ag).
________________________________
FONTES:















Comentários